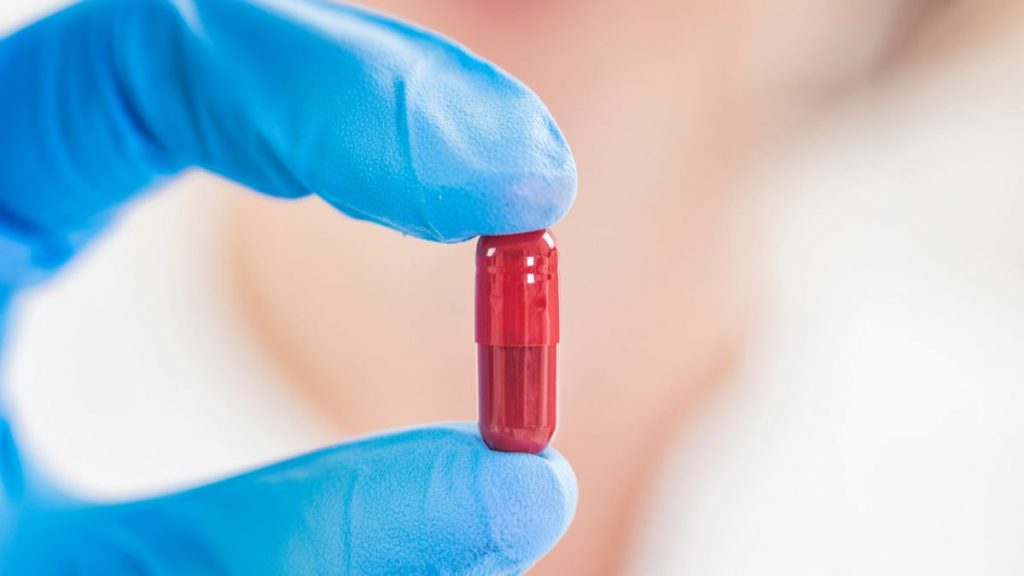

Pfizer a dévoilé les premiers résultats d’un essai clinique pour sa pilule antivirale. Ceux-ci montrent une réduction de près de 90 % des taux d’hospitalisation et de décès chez les patients à risque atteints d’infections légères à modérées.
Un inhibiteur de protéase
Le médicament est un inhibiteur de protéase, initialement développé pour le SARS-CoV-1 en 2003. Conçu pour bloquer une enzyme dont le coronavirus a besoin pour se multiplier dans l’organisme, celui-ci est destiné aux personnes nouvellement infectées les plus vulnérables au Covid (âge avancé, obésité et problèmes de santé sous-jacents). Les résultats de l’étude de Pfizer semblent dépasser ceux de la pilule de Merck, réduisant de moitié la probabilité de décès ou d’hospitalisation des patients présentant un risque élevé de forme grave.
« Les données préliminaires de notre essai suggèrent que notre candidat antiviral oral a le potentiel de sauver la vie des patients, de réduire la gravité des infections Covid-19 et d’éviter jusqu’à neuf hospitalisations sur dix », a déclaré le groupe pharmaceutique. Si ces résultats sont confirmés, le traitement, impliquant la prise de trois comprimés deux fois par jour, pourrait contribuer à soulager les services de santé dans les zones du globe où les taux de vaccination sont faibles.
L’étude de Pfizer a porté sur les hospitalisations ou les décès survenus chez 775 personnes non vaccinées chez qui une forme légère à modérée du Covid-19 avait été diagnostiquée. Ces derniers présentaient au moins un facteur de risque de développer une forme grave. Le traitement a débuté dans les trois à cinq jours suivant l’apparition des symptômes et a duré cinq jours au total.


Des résultats préliminaires rassurants
L’étude a révélé que seuls 0,8 % des patients ayant reçu la pilule de Pfizer dans les trois jours suivant l’apparition des symptômes avaient dû être hospitalisés et qu’aucun décès n’avait été enregistré au sein du groupe dans les 28 jours suivant le traitement. En comparaison, le taux d’hospitalisation était de 7 % pour les patients ayant reçu un placebo, avec sept décès. Les taux étaient similaires pour les patients traités dans les cinq jours suivant l’apparition des symptômes : 1 % du groupe traité a été hospitalisé, contre 6,7 % pour le groupe placebo, dont 10 décès.
Bien que les effets secondaires du médicament n’aient pas encore été détaillés, Pfizer a déclaré que des effets indésirables d’intensité légère avaient été rapportés dans environ 20 % des cas, qu’il s’agisse des patients ayant reçu le traitement ou le placebo.
Sur recommandation d’un groupe d’experts indépendants, l’étude a été interrompue en raison de la nature positive des résultats provisoires. Pfizer a annoncé qu’il allait demander aux autorités réglementaires internationales l’autorisation immédiate d’utiliser son médicament. Les données complètes de l’essai devraient être publiées dans les prochaines semaines.













































MDR !!