Des chercheurs de l’université de Pittsburgh ont identifié un nouveau composé qui pourrait aider à réduire les dommages consécutifs à un accident vasculaire cérébral, avec des tests effectués sur des souris s’étant avérés particulièrement prometteurs.
Empêcher la mort cellulaire
Susceptible d’entraîner des séquelles irréversibles, un accident vasculaire cérébral (AVC) survient lorsqu’un vaisseau sanguin du cerveau se bouche, bloquant la circulation sanguine et entraînant la mort des neurones privés d’oxygène. Mais il s’avère que les cellules nerveuses se trouvant à proximité immédiate ne sont pas les seules à être impactées. Les neurones des zones environnantes, sur lesquels se sont spécifiquement concentrés les chercheurs dans le cadre de cette nouvelle étude publiée dans la revue Science Advances, peuvent également être touchés et mourir des heures voire des jours après la survenue de l’événement lui-même.
« Nous cherchons à éviter que ces autres neurones ne meurent également », explique Elias Aizenman, auteur principal de l’étude. « En y parvenant, la récupération pourrait s’en trouver améliorée et nous pourrions mieux aider les personnes qui ont subi un AVC dans lequel le caillot se trouve dans un vaisseau sanguin inaccessible ou qui n’ont pas pu se rendre à l’hôpital à temps pour une intervention précoce. Avec le bon composé, nous pourrions également être en mesure de ralentir la progression d’un AVC avant qu’un patient n’arrive à l’hôpital. »
Précédemment, l’équipe avait découvert que les ions s’échappant d’un canal potassique appelé Kv2.1 pouvaient entraîner la mort des neurones, via des interactions entre le canal et une protéine appelée syntaxine, et était parvenue à influer sur celles-ci et à empêcher la mort cellulaire en s’appuyant sur un composé appelé TAT-C1aB. En s’appuyant sur ces recherches, les scientifiques ont développé un composé expérimental offrant des résultats particulièrement prometteurs chez la souris.
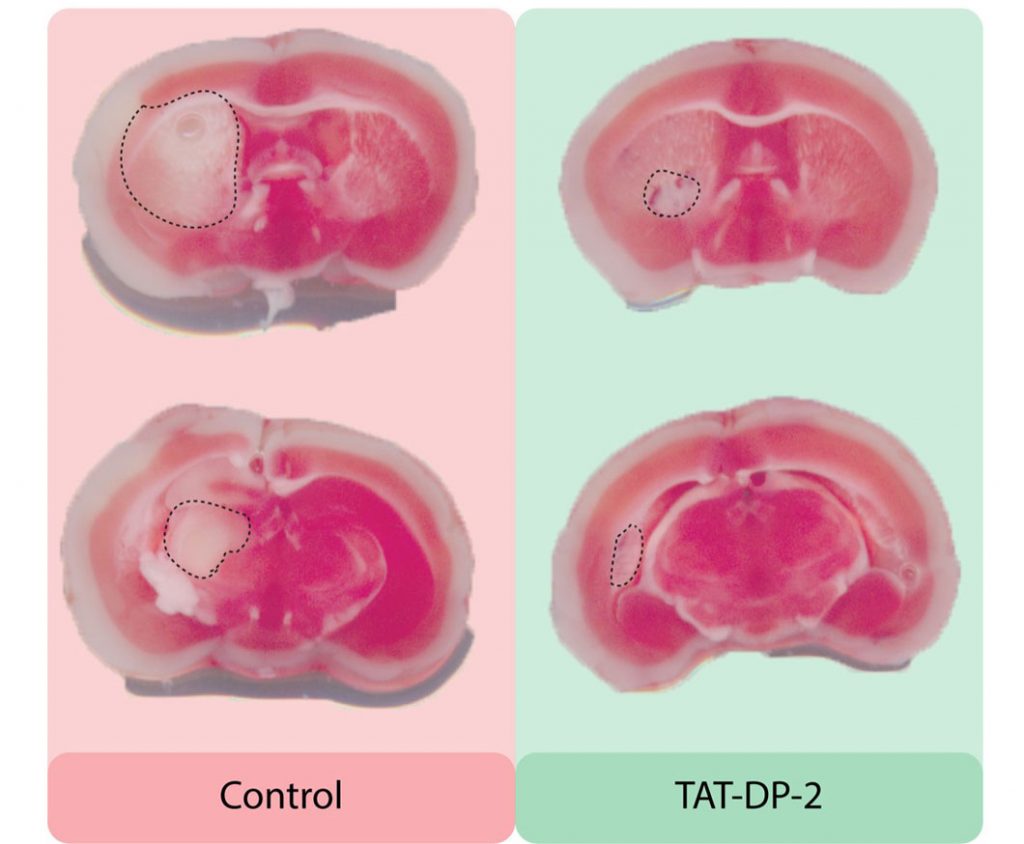
Une large réduction de la zone cérébrale endommagée chez la souris
Dans le cadre de cette nouvelle étude, les chercheurs ont identifié un moyen potentiel d’utiliser cette approche pour réduire davantage la mort des cellules après un accident vasculaire cérébral. Leurs expériences on en effet révélé qu’il existait deux types de canaux Kv2.1 dans la membrane des neurones, et que l’un d’eux permettait aux canaux Kv2.1 supplémentaires de se frayer un chemin à travers la cellule. Ce qui avait pour effet d’augmenter la quantité de potassium perdue et, par conséquent, la mort cellulaire.
Afin d’éviter les fuites de potassium et de maintenir les neurones en vie, l’équipe a développé une petite protéine appelée TAT-DP-2, empêchant les nouveaux canaux de passer à travers la cellule. Lors de tests réalisés sur des souris, il s’est avéré que la zone cérébrale endommagée à la suite d’une attaque était beaucoup moins étendue chez les animaux ayant reçu des injections de TAT-DP-2, par rapport aux spécimens témoins. Les chercheurs ont par ailleurs découvert que les souris traitées présentaient également un meilleur fonctionnement neurologique à long terme.
Bien que l’étude se révèle prometteuse, les chercheurs rappellent que des recherches supplémentaires seront nécessaires afin de savoir si cette approche offre des résultats similaires chez l’Homme. L’espoir étant de pouvoir proposer un médicament pouvant être administré même après un accident vasculaire cérébral pour réduire les dommages et améliorer la récupération.
« Il n’existe aujourd’hui aucun médicament testé cliniquement qui soit capable d’enrayer la mort cellulaire après un accident vasculaire cérébral », déclare Anthony Schulien, premier auteur de l’étude. « Ces travaux fournissent des preuves passionnantes et précoces de cibles de médicaments que nous espérons pouvoir un jour administrer aux patients humains. »
Par Yann Contegat, le
Source: New Atlas
Étiquettes: neurone, accident vasculaire cérébral, cerveau, AVC
Catégories: Santé, Actualités
