L’Homme a toujours poursuivi le rêve d’atteindre l’immortalité et de repousser les limites de la vie. Mais qu’en est-il du point de vue biologique ? L’espèce humaine pourrait-elle un jour vaincre la mort ? DGS vous apporte quelques éléments de réponse.
L’immortalité est loin d’être un concept abject et existe même sur notre planète. Mais il conviendrait davantage de le remplacer par l’expression « immortalité biologique », comme l’explique Thomas Bosch, de l’université de Kiel, en Allemagne : « Immortel veut dire que vous ne mourrez pas du tout, ce qui est stupide. » Ainsi, les organismes « immortels » sont en réalité mortels, puisqu’ils peuvent être tués par un prédateur, une maladie ou un changement catastrophique dans leur environnement, comme un volcan en éruption.

CERTAINS ORGANISMES NE SUBISSENT PAS LES EFFETS DU TEMPS
Bien qu’aucun organisme ne soit réellement immortel, dans le sens où il ne craindrait pas la mort, certains sont « biologiquement » immortels, c’est-à-dire qu’ils ne subissent pas les effets du temps. Le pin Bristlecone est un exemple de ces organismes. Ainsi, quelques-uns de ces arbres d’Amérique du Nord sont étonnamment vieux puisqu’ils ont commencé à pousser il y a 5000 ans. « Ces arbres [millénaires] sont plutôt amochés », selon Howard Thomas de l’université d’Aberystwyth, au Royaume-Uni. « Ils sont frappés par la foudre, les tempêtes de neige, et les branches se cassent. » En d’autres termes, un vieux pin Bristlecone a visiblement l’air d’avoir subi les effets du temps, mais à y regarder de plus près, le constat est tout autre.
Une étude publiée en 2001 compare le pollen et les grains de pins Bristlecone de tous âges, certains datant de 4700 ans, et n’a trouvé aucune augmentation significative des taux de mutations liés à la vieillesse. Ces recherches montrent également que les tissus vasculaires fonctionnent tout aussi bien chez les anciens arbres que chez les plus jeunes. Bien entendu, les pins âgés sont abîmés, mais au niveau cellulaire, semblent être aussi jeunes que lors de leur apparition, et leurs tissus ne semblent pas avoir été flétris par le temps.

Personne ne sait réellement comment perdure le pin Bristlecone car sa longévité n’est pas aussi étudiée que l’on pourrait s’y attendre. Mais Howard Thomas pense que cela viendrait d’une propriété de certains arbres : les « méristèmes », des morceaux de racines et de pousses qui abritent des populations de cellules souches qui entrainent une nouvelle croissance et peuvent apparemment rester jeunes et vigoureuses pendant des millénaires. Le scientifique explique ainsi que « lorsqu’il y a des mutations, les choses peuvent mal tourner, mais les cellules non mutées peuvent mieux fonctionner que celles qui sont endommagées ».
Selon Lieven De Veylder, de l’université de Ghent, en Belgique, un facteur clé de la longévité de ces arbres pourrait être une petite population de cellules dans les plantes méristèmes appelées le centre quiescent. Là, les cellules se divisent à un taux largement réduit et cela pourrait même supprimer la division des cellules souches méristèmes. Cela pourrait s’avérer utile puisque chaque fois qu’une cellule se divise, elle court le risque d’incorporer une mutation potentiellement dangereuse dans son ADN. « Garder une sous-population de cellules souches qui ne se divisent que rarement peut être un moyen de garder un génome originel proche de la perfection », selon De Veylder.
En 2013, l’équipe de Lieven De Veylder a identifié une protéine qui semble contrôler l’activité dans le centre quiescent d’une plante appelée Arabidopsis. Des protéines similaires pourraient aider des plantes comme le pin Bristlecone à éviter le vieillissement cellulaire, permettant à certains d’entre eux de vivre durant des milliers d’années. En revanche, les cellules des méristèmes peuvent parfois subir un vieillissement et dégrader son hôte, comme l’explique Howard Thomas : « Une vague de sénescence peut envahir le comportement du méristème et transformer le végétal en plante annuelle ou bisannuelle. »
DES PROTÉINES POURRAIENT AIDER CERTAINES PLANTES À ÉVITER LE VIEILLISSEMENT CELLULAIRE
En 2013, l’équipe de Lieven De Veylder a identifié une protéine qui semble contrôler l’activité dans le centre quiescent d’une plante appelée Arabidopsis. Des protéines similaires pourraient aider des plantes comme le pin Bristlecone à éviter le vieillissement cellulaire, permettant à certains d’entre eux de vivre durant des milliers d’années. En revanche, les cellules des méristèmes peuvent parfois subir un vieillissement et dégrader son hôte, comme l’explique Howard Thomas : « Une vague de sénescence peut envahir le comportement du méristème et transformer le végétal en plante annuelle ou bisannuelle. »
Ainsi, les cellules de plantes comme Arabidopsis travaillent et se divisent si vite que leurs organes se consument avant que le méristème puisse reconstituer le tissu endommagé. En revanche, les plantes biologiquement immortelles vivent à un rythme plus lent. « Adopter l’activité du méristème est un modèle de longévité d’organes individuels », selon Howard Thomas.

Les animaux vivent bien souvent moins longtemps que les végétaux, mais il existe plusieurs exceptions à cela : certains animaux coloniaux, comme les coraux, peuvent vivre plus de 4000 ans. Egalement, un quahog nordique retrouvé dans les eaux côtières de l’Islande en 2006, s’est avéré être âgé de 507 ans lorsque les biologistes l’ont étudié, et par là même, tué. Cette longévité exceptionnelle a fait de Ming, tel que l’ont nommé les scientifiques qui ont trouvé le mollusque, l’animal solitaire le plus vieux jamais répertorié.
Mais Ming aurait techniquement pu être biologiquement immortel. Car si dans de nombreuses cellules animales, les molécules contenant de l’oxygène réagissent avec les membranes, générant de petites molécules qui endommagent successivement plusieurs parties de la cellule, une étude datant de 2012 a montré que les cellules de quahogs nordiques sont faites de membranes qui sont anormalement résistantes à ces dommages. Ainsi, Ming pourrait avoir vécu aussi longtemps grâce à ses cellules qui, comme celles du pin Bristlecone, vieillissent dans une très faible proportion.
D’une manière générale, les petits animaux ne vivent pas aussi longtemps que les grands. Mais l’hydre, un petit animal à corps mou apparenté à la famille des méduses, vient contredire cette tendance. Un biologiste a par exemple réalisé l’expérience de garder une hydre en laboratoire pendant plus de quatre ans, une période de temps étonnamment longue pour un animal qui mesure généralement à peine 15 mm. Mais curieusement, à la fin de l’expérience, l’hydre parut aussi jeune qu’au premier jour, ce qui fait de cet animal un autre cas d’individu biologiquement immortel.

Et si personne ne sait combien de temps peut vivre une hydre, Thomas Bosch et ses collègues, il y a quelques années, ont offert une explication à l’absence de vieillissement cellulaire chez cet animal aquatique. Selon les scientifiques, l’organisme de l’hydre reviendrait simplement à un état de cellules souches. Car ce polype contient un ensemble remarquablement puissant de cellules souches dans son corps, si efficace qu’il peut faire repousser des morceaux importants du corps en cas d’accident. C’est d’ailleurs cette capacité qui valu son nom à l’hydre, faisant référence à la mythologique Hydre de Lerne, qui pouvait faire repousser ses têtes décapitées.
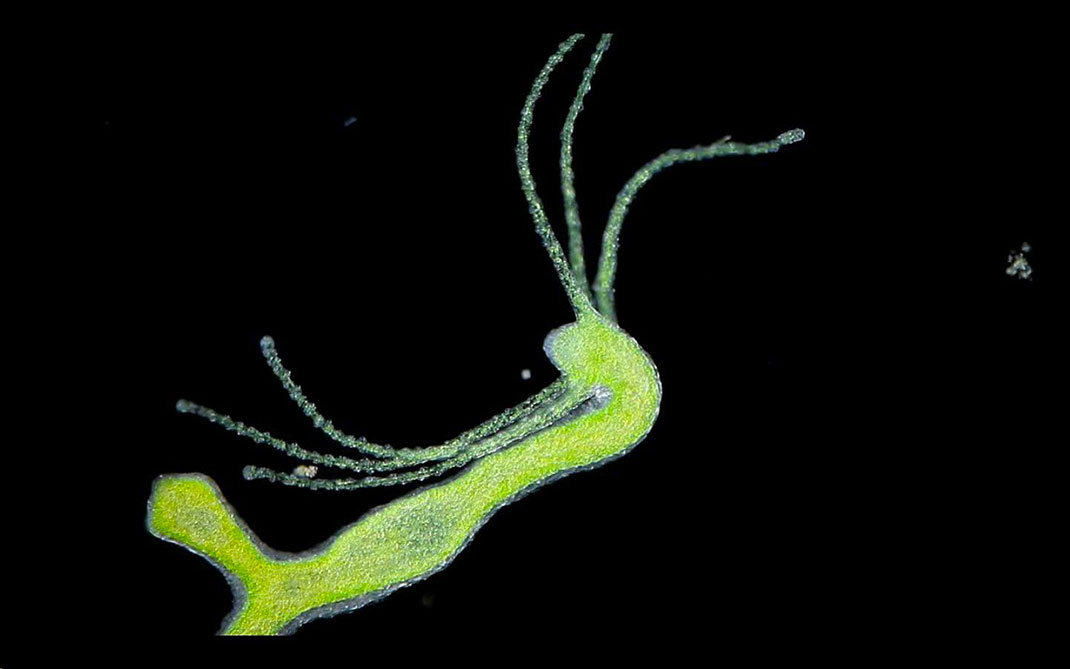 La capacité régénérative de l’hydre est également cruciale pour sa reproduction, puisque l’animal ne se reproduit pas sexuellement, mais se développe en créant de petits clones de lui-même. Pour ce faire, il utilise trois populations distinctes de cellules souches pour reproduire l’ensemble des différents tissus qui forment un animal entièrement fonctionnel. Bosch et ses collègues ont constaté que les trois types de cellules partagent une protéine commune : FoxO. De plus, les scientifiques estiment qu’il s’agirait d’une protéine anti-vieillissement.
La capacité régénérative de l’hydre est également cruciale pour sa reproduction, puisque l’animal ne se reproduit pas sexuellement, mais se développe en créant de petits clones de lui-même. Pour ce faire, il utilise trois populations distinctes de cellules souches pour reproduire l’ensemble des différents tissus qui forment un animal entièrement fonctionnel. Bosch et ses collègues ont constaté que les trois types de cellules partagent une protéine commune : FoxO. De plus, les scientifiques estiment qu’il s’agirait d’une protéine anti-vieillissement.
LA PROTÉINE FoxO POUR ÊTRE UN MÉCANISME D’ANTI-VIEILLESSEMENT UNIVERSEL
La manière dont FoxO empêche le vieillissement de l’hydre, et en particulier de ses cellules souches, n’est pas encore claire. Mais nous savons d’ores et déjà qu’elle agit comme un sanctuaire dans la cellule qui intègre divers signaux moléculaires, incluant certains signaux de l’environnement externe de la cellule. « Nous travaillons actuellement sur la façon dont ces signaux environnementaux sont intégrés à la protéine FoxO », selon Bosch. Mais plus qu’une molécule propre à l’hydre, FoxO pourrait en réalité être un mécanisme anti-vieillissement universel dans tout le règne animal puisque les humains en portent eux-mêmes quelques versions, et que certaines variantes sont plus fréquentes chez les personnes qui dépassent les 100 ans.

Autre animal immortel, mais d’une manière différente : la méduse Turritopsis dohrnii. En temps normal, lorsque du sperme et un ovule de méduse se rencontrent, ils forment une petite larve. Mais celle-ci ne se contente pas de se développer en un spécimen adulte. Elle tombe vers le fond jusqu’à une surface dure et se transforme en une structure molle à branches appelée polype. La plupart du temps, ces minuscules polypes produisent des clones d’eux-mêmes, comme le fait l’hydre. Mais chez certaines espèces, le polype fait autre chose, il produit de petites méduses mâles ou femelles qui nagent librement, se développent en adultes et produisent à leur tour du sperme et des ovules, recommençant le cycle.
UN INDIVIDU ADULTE PEUT REVENIR À L’ÉTAT DE POLYPE, ÉCHAPPANT AINSI À LA MORT
La majorité des méduses peuvent inverser leur développement au cours de la plupart des étapes de ce cycle de vie complexe. Mais une fois qu’elles deviennent adultes et sexuellement matures, elles perdent cette capacité à remonter le temps. Seules deux espèces de méduses, Turritopsis nutricula et Turritopsis dohrnii, désobéissent à cette règle fondamentale. Car chez ces spécimens, même un individu adulte peut revenir à l’état de polype, échappant ainsi à la mort et atteignant l’immortalité théorique. Comme dans la plupart des cas d’immortalité biologique, on ne sait exactement comment les deux espèces peuvent rajeunir. Il semblerait cependant qu’elles inversent le processus cellulaire classique qui se produit durant leur développement.
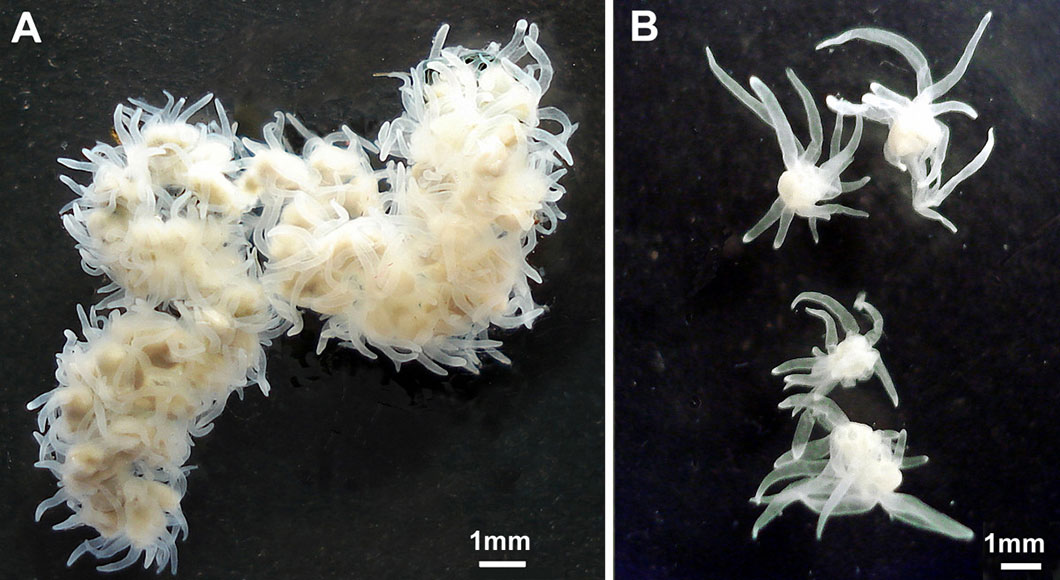
Les méduses ont beaucoup de dissimilitudes avec les autres animaux, comme c’est le cas pour leur reproduction asexuée ou leur immortalité. Et ces deux caractéristiques pourraient même être liées entre elles, selon Bosch. Car si les cellules souches jouent un rôle vital dans l’immortalité biologique animale, alors les individus transportant de puissantes cellules souches pour se cloner eux-mêmes sont censés être immortels. Inversement, une stratégie reproductive construite autour des rapports sexuels est presque toujours l’assurance de la mort.
« C’est sûrement parce qu’il faut beaucoup d’énergie pour produire des gamètes (les oeufs et le sperme), de sorte que cela finit par tuer l’animal », selon Bosch. Mais même chez les animaux reproducteurs, l’immortalité biologique n’est pas impossible et le homard américain en est un parfait exemple. Si la plupart des animaux cessent plus ou moins de grandir lorsqu’ils atteignent la majorité sexuelle, ce n’est pas le cas du Homarus americanus, qui profite même d’une autre caractéristique étonnante : celle de faire repousser l’un de ses membres lorsqu’il le perd. Associées, ces deux caractéristiques suggèrent que ces animaux conservent une capacité impressionnante à se régénérer, même à un âge adulte avancé. Cela pourrait expliquer pourquoi l’âge de certains gros spécimens est estimé à au moins 140 ans.

LES CELLULES DES HOMARDS AMÉRICAINS NE VIEILLISSENT PAS NORMALEMENT
La longévité des homards peut être reliée au comportement de leur ADN. Ainsi, en temps normal, les longs chromosomes des animaux se terminent par des télomères qui aident à protéger l’ADN. Et à chaque fois que la cellule se divise et que les chromosomes sont répliqués, les télomères raccourcissent un peu parce que le processus de réplication ne peut pas atteindre l’extrémité du chromosome. Des télomères plus courts impliquent donc une durée de vie plus courte, mais les homards américains retardent l’inévitable en utilisant une enzyme, appelée télomérase, et qui allonge les télomères.
Une étude de 1998 a montré que cette enzyme se trouve dans tous leurs organes, où elle contribue certainement à garder les cellules jeunes plus longtemps. En d’autres termes, les cellules de homards américains ne vieillissent pas normalement, les rendant biologiquement immortels. Cette astuce naturelle serait présente chez plusieurs types de mammifères, comme, possiblement, chez l’Homme.
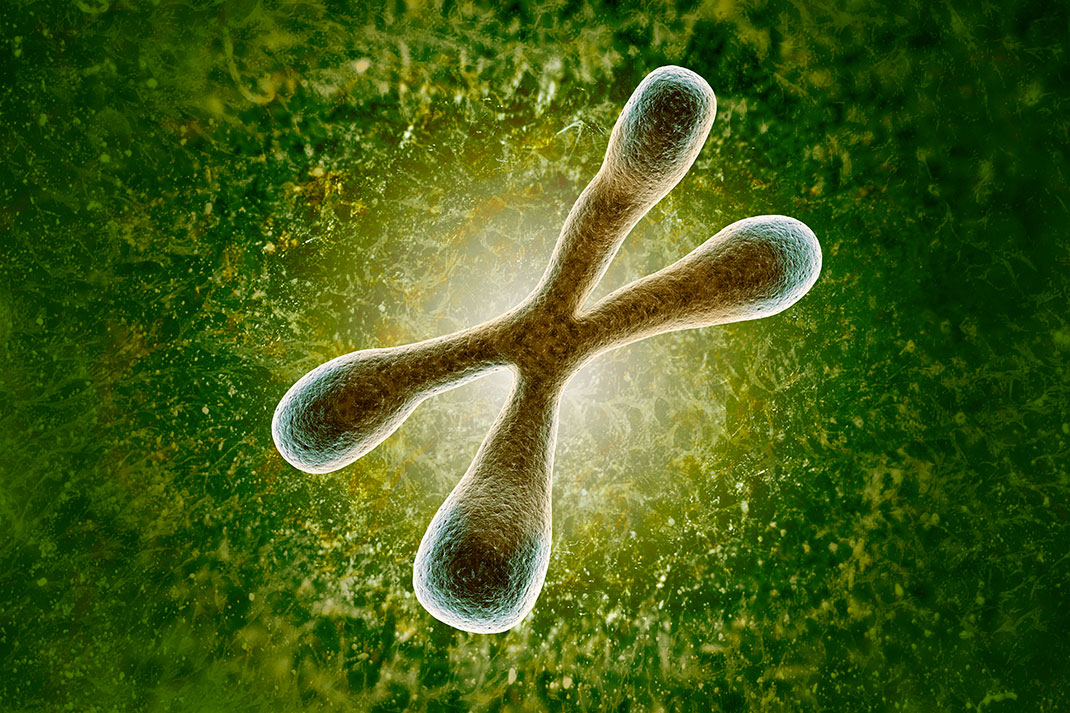
Chez Henrietta Lacks, une patiente morte en 1951 d’un cancer de l’utérus, des scientifiques ont trouvé une lignée cellulaire cancéreuse prélevée d’une de ses métastases : les cellules HeLa. Celles-ci, dont on constata qu’elles étaient immortelles, était dotées d’enzymes télomérases, qui semblent aider les tumeurs à se développer et à se propager, ce qui pourrait expliquer pourquoi les mammifères les utilisent dans certains types de cellules. Paradoxalement, les cellules HeLa étaient bien immortelles, mais coûtèrent à leur porteuse sa vie.
En revanche, les cellules cancéreuses ne sont pas les seules cellules immortelles que l’on peut trouver dans le corps humain. Ainsi, nos cellules de la lignée germinale ne vieillissent pas non plus. Ce sont les cellules qui produisent les oeufs et le sperme et peuvent résister au vieillissement afin que les bébés naissent jeunes. Et si la « jeunesse » des enfants à naître pourrait sonner comme une évidence, il n’est en rien, et c’est notamment ce qu’a montré la brebis Dolly, clonée en laboratoire.
CERTAINES DES CELLULES HUMAINES DE VIEILLISSENT PAS
Dolly a été clonée à partir de cellules de la glande mammaire d’un mouton, qui ne sont pas protégées du vieillissement. L’animal est donc né relativement « vieux », tout du moins du point de vue cellulaire. Car les télomères dans les cellules de Dolly étaient courts, et la « jeune » brebis vieillissait beaucoup plus vite que ses pairs non clonés. Finalement, elle mourut à l’âge de six ans à cause d’une maladie pulmonaire.
Pour ce qui est de l’Homme, la clé de l’immortalité serait « d’avoir un mécanisme qui pourrait réinitialiser l’horloge » selon Howard Thomas. Le problème reste que nous ne savons pas encore comment se réinitialisent nos cellules germinales, même si les enzymes télomérases sont probablement un des facteurs importants. Pour l’instant, nous sommes donc encore loin de pouvoir inverser notre propre vieillissement.
Ce que nous apprend l’étude d’autres espèces, animales comme végétales, est réellement passionnant. Car cela nous permet de comparer d’autres organismes avec les nôtres, et au fur et à mesure, de repousser les limites de la vie. Si la quête d’immortalité vous intéresse, découvrez également le concept de cryogénisation, cette technique consistant à geler un corps mort dans l’espoir de le réanimer.







