Pour la première fois, l’outil révolutionnaire d’édition génétique CRISPR a été utilisé directement sur un patient humain, dans le cadre d’un essai clinique visant à traiter une mutation génétique provoquant la cécité.
Une grande première
Depuis sa mise au point en 2012, la technique CRISPR s’est révélée prometteuse en tant que nouveau moyen potentiel de traiter toute une série d’affections génétiques. L’outil permet aux médecins d’isoler les sections problématiques de l’ADN, pouvant être à l’origine de différentes maladies, et de les découper à l’aide de ciseaux génétiques.
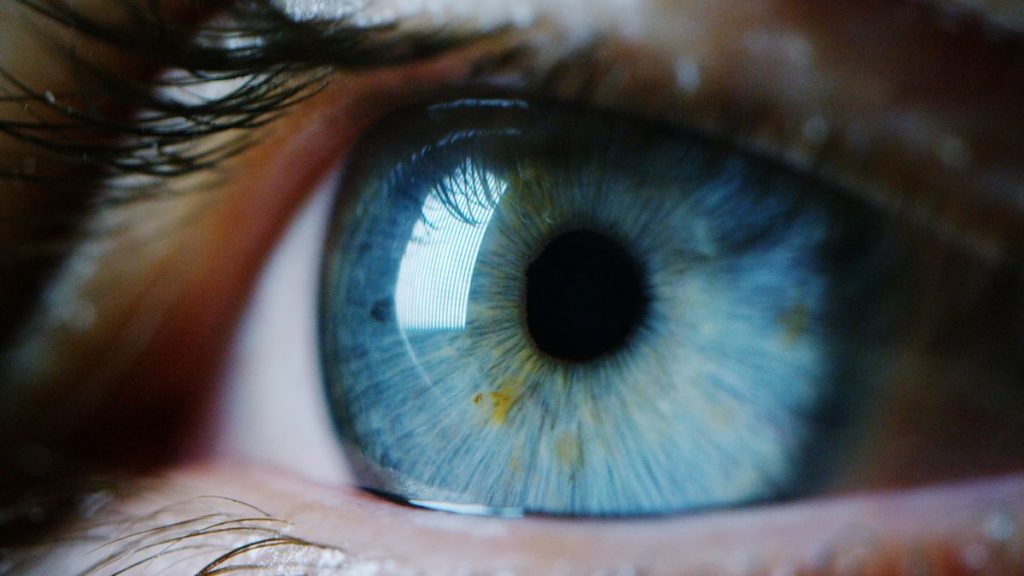
Le nouvel essai, mené à l’Université de la santé et des sciences de l’Oregon et en partie financé par des sociétés privées, cible une forme d’amaurose congénitale de Leber (ACL). Cette maladie rare est déclenchée par une mutation génétique affectant la rétine, ce qui fait que les patients naissent aveugles ou perdent la vue au cours des premières années de leur vie.
Pour ce type particulier d’ACL, la mutation se produit sur un gène appelé CEP290, ciblé par l’essai : les chercheurs ont injecté une substance contenant les ciseaux génétiques directement dans les cellules photoréceptrices situées derrière la rétine du patient, afin d’éliminer le gène défectueux.
Si la technique d’édition CRISPR avait déjà été utilisée précédemment chez l’homme, les cellules avaient été extraites du corps du patient, avant d’être traitées puis replacées. C’est donc ici la première fois qu’un tel procédé est mis en œuvre in vivo – directement à l’intérieur du corps humain.
L’édition in vivo des gènes pourrait permettre de traiter un large éventail de maladies
« Le fait de pouvoir modifier les gènes directement à l’intérieur du corps humain laisse entrevoir de nombreuses possibilités », estime Mark Pennesi, ayant supervisé l’essai. « Au-delà de la possibilité de traiter une forme de cécité jusqu’alors incurable, l’édition in vivo des gènes pourrait également permettre de traiter un éventail beaucoup plus large de maladies. »
Le traitement est conçu pour être permanent pour les patients, mais ne les empêchera pas de transmettre la mutation génétique responsable de la cécité à leurs enfants. Il s’agit d’une distinction importante, car l’un des principaux risques de la thérapie génique reste que si quelque chose venait à mal tourner, cela pourrait modifier le patrimoine génétique humain à l’échelle de plusieurs des générations. Une crainte s’étant concrétisée en 2018, lorsque des expériences illégales avaient conduit à la naissance des premiers bébés issus de la thérapie génique.
Jusqu’à présent, ce traitement n’a été utilisé que sur un seul patient, et il est encore trop tôt pour que les résultats soient évalués. Au total, 18 autres sujets devraient subir la même opération, ce qui devrait permettre aux chercheurs de s’assurer du bon fonctionnement du traitement, de son caractère sûr et de sa tolérance par l’organisme.
Par Yann Contegat, le
Source: New Atlas
Étiquettes: adn, cecite, crispr, édition génétique
Catégories: Actualités, Santé
