Combinant des composants de bactéries appelées mycoplasmes avec un génome synthétisé chimiquement, des chercheurs américains ont conçu des cellules synthétiques capables de croître et de se diviser en cellules de forme et de taille uniformes.
Des travaux fondateurs
En 2016, Craig Venter et ses collègues étaient parvenus à créer des cellules synthétiques « minimales », dont le génome était uniquement composé de 473 gènes clefs, considérés comme essentiels à la vie. Baptisées JCVI-syn3.0, celles-ci avaient pu croître et se diviser sur de la gélose (substance nutritive favorisant ou inhibant la prolifération et le développement des bactéries), produisant des groupes de cellules appelés colonies.
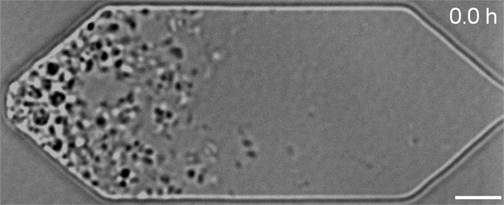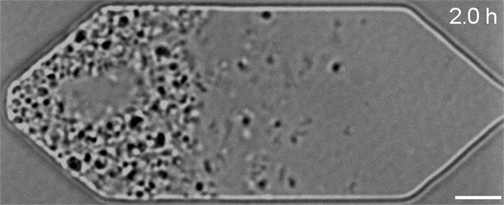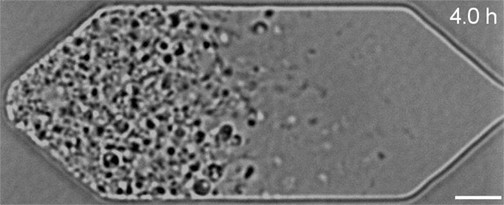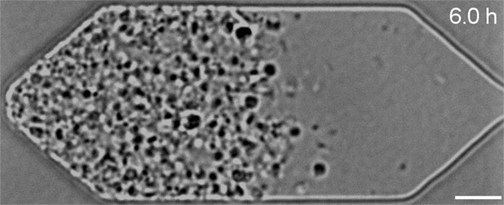
Mais en examinant de plus près les cellules en division, l’équipe avait remarqué qu’elles ne se divisaient pas de manière uniforme et régulière, comme le font la plupart des bactéries naturelles : celles-ci produisaient au contraire des cellules filles de formes et de tailles étranges.
« Les créateurs de JCVI-syn3.0 avaient éliminé toutes les parties du génome qu’ils jugeaient non essentielles à leur développement », commente Elizabeth Strychalski, chercheuse à l’Institut national des normes et de la technologie des États-Unis et auteure principale de la nouvelle étude. « Ce qui leur avait permis d’obtenir de belles colonies sur une plaque de gélose, mais pas de produire des cellules se divisant de manière uniforme et réaliste. »
Sept gènes supplémentaires pour obtenir une division et une croissance uniformes
Dans le cadre de travaux présentés dans la revue Cell, Strychalski et son équipe ont réintroduit divers gènes dans ces cellules bactériennes synthétiques et ont ensuite observé au microscope l’effet de ces ajouts sur leur développement. Au total, sept gènes supplémentaires nécessaires à la division uniforme des cellules ont été identifiés. Lorsque ces derniers ont été ajoutés à JCVI-syn3.0, ils ont permis de rétablir une division et une croissance régulières.
Si deux d’entre eux étaient déjà connus pour leur implication dans la division cellulaire, la fonction des cinq autres reste pour l’heure un mystère.
« Ils sortent du cadre de ce que nous connaissons », explique James Pelletier, chercheur au Massachusetts Institute of Technology et coauteur de l’étude. « La cellule minimale possède de nombreux gènes dont le rôle demeure inconnu, mais qui se révèlent nécessaires à la vie de la cellule. Il s’agit donc d’un domaine passionnant pour de futures recherches. »
« Les cellules synthétiques constituent à la fois un outil pour la recherche fondamentale et la biotechnologie »
« La recherche fondamentale sur les cellules minimales, qui constituent de bons analogues des derniers ancêtres communs universels de toute vie sur Terre, nous aide à comprendre les principes régissant sa formation et son évolution », estime Kate Adamala de l’université du Minnesota.
« Cette nouvelle percée nous rapproche également de l’ingénierie de cellules vivantes entièrement définies, comprises et contrôlables », poursuit la chercheuse. « Libérées de la complexité des systèmes vivants naturels, les cellules synthétiques constituent à la fois un outil pour la recherche fondamentale et la biotechnologie. »
« Les applications potentielles sont vastes, dans les domaines de l’agriculture, de la nutrition, de la biomédecine et de l’assainissement de l’environnement », estime de son côté Jef Boeke, de l’université de New York. « La capacité de corriger et d’affiner le code biologique de cette façon représente une étape clé pour y parvenir. »
Par Yann Contegat, le
Source: New Scientist
Étiquettes: vie, cellule, synthétique, minimale
Catégories: Actualités, Sciences
